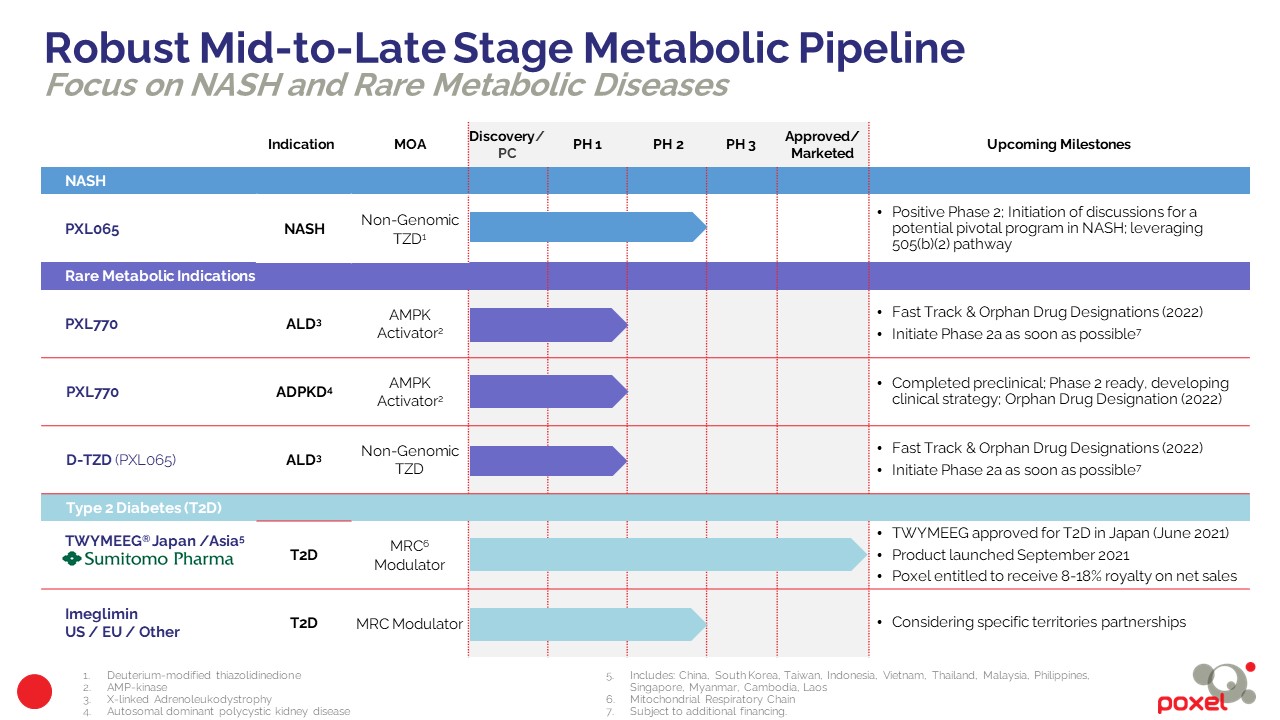
NASH
PXL065
Le PXL065, stéréoisomère R de la pioglitazone modifié par substitution au deutérium, fait l'objet d’une étude de Phase II (DESTINY-1). Bien que la pioglitazone ne soit pas autorisée par la FDA pour le traitement de la NASH, ce médicament est le plus largement étudié dans la NASH, et une étude de Phase IV a montré sa capacité à « résoudre et améliorer la NASH dans le traitement de la fibrose ». La pioglitazone est le seul médicament recommandé pour les patients atteints d’une NASH confirmée par biopsie par les Directives Pratiques publiées par l’AASLD (American Association for the Study of Liver Diseases) et par l’EASL (European Association for the Study of the Liver). Toutefois, son emploi hors indication pour la NASH est restreint en raison des effets indésirables liés à l’activation des récepteurs PPARγ, tels que la prise de poids, les fractures osseuses et la rétention d’eau.
La pioglitazone est un mélange en proportion égales de deux molécules miroirs (stéréoisomères R et S) qui s’interconvertissent in vivo. Par substitution au deutérium, la Société est parvenue à stabiliser chaque stéréoisomère et à définir leurs propriétés pharmacologiques opposées. Des études in vitro ont montré que le PXL065 n’a que peu d’activité PPARγ et il reproduit de manière sélective les effets non génomiques de la pioglitazone, liés au thiazolidinedione (TZD).Des modèles animaux précliniques ont mis en évidence que le PXL065 pourrait avoir une efficacité similaire à celle de la pioglitazone dans le traitement de la NASH, mais avec un profil d’effets secondaires amélioré en ce qui concerne la prise de poids et l’œdème, effets secondaires associés au stereoisomère S de la pioglitazone. Les résultats précliniques, de Phase I et de Phase II obtenus à ce jour, renforcent l’hypothèse de Poxel selon laquelle le profil thérapeutique supérieur à celui de la pioglitazone pour la NASH. Des premiers résultats positifs de DESTINY-1 ont été annoncés en août 2022, et les résultats histologiques sont attendus en septembre.
Les résultats de l’étude de phase II de l’étude pour le PXL065 dans la NASH (DESTINY-1) disponibles à ce jour montrent une réduction statistiquement significative du taux de masse grasse dans le foie d'autres marqueurs de fibrogénèse/risque de fibrose, ainsi que des effets positifs sur la fibrose et d'autres paramètres clés issus de l'analyse histologique. Par rapport aux données publiées sur la pioglitazone, la réduction des effets secondaires, tels que la prise de poids et l’apparition d'œdème est également manifeste. Sur la base des résultats précliniques, de Phase I et des résultats préliminaires de Phase II obtenus à ce jour, Poxel estime que le PXL065 pourrait avoir un profil thérapeutique supérieur à celui de la pioglitazone dans la NASH et pourrait également présenter des propriétés intéressantes dans d’autres indications, telles que l'adrénoleucodystrophie (ALD).
NASH
Maladies métaboliques rares
Le PXL770 et la plateformes de molécules de thiazolidinediones deutérées (TDZ) (PXL065) dans l’adrénoleukodystrophie (ALD)
Le PXL770 est un activateur oral direct de l'AMPK, premier de sa classe. Le développement clinique des Phases I et IIa à ce jour a démontré l'engagement de la cible et la traduction de plusieurs paramètres d'efficacité métabolique chez l'homme, ce qui suggère la probabilité d'une traduction plus large de ce mécanisme. Il a été observé que le PXL770 améliore les principales caractéristiques de l'ALD dans des modèles précliniques, y compris à la fois des cellules dérivées de patients et un modèle classique de maladie de rongeur.
Il a été observé que le PXL065 améliore les principales caractéristiques de l'ALD dans des modèles précliniques, y compris à la fois les cellules dérivées de patients et dans un modèle classique de maladie de rongeur. Une demande de « nouveau médicament de recherche » (« Investigational New Drug », ou « IND ») a été soumise pour l'ALD/AMN auprès de l'autorité américaine de santé. Les données précliniques et les récents résultats cliniques positifs avec une molécule apparentée - la lériglitazone (Minoryx) - appuient l'utilité potentielle du PXL065 dans l'ALD. Le PXL065 se différencie de la pioglitazone et de la lériglitazone de plusieurs manières, notamment par son potentiel d'efficacité accrue et de réduction des effets secondaires.
Dans l’ALD, une étude clinique de preuve de concept par biomarqueurs de Phase IIa sur le PXL770 sera lancée dès que possible, sous réserve de financements additionnels. L'accent initial sera mis sur les patients atteints d'adrénomyéloneuropathie (AMN), le sous-type d'ALD le plus fréquent. Chaque étude recrutera des patients adultes, de sexe masculin, souffrant d’AMN et évaluera la pharmacocinétique, la sécurité et l'efficacité du PXL065 après 12 semaines de traitement sur la base de biomarqueurs pertinents de la maladie, tels que l’effet sur les acides gras à très longue chaîne (VLCFA), le marqueur plasmatique caractéristique de la maladie. Compte tenu des résultats de DESTINY-1 pour PXL065 dans la NASH, qui ont validé l’intérêt de la plateforme de thiazolidinediones deutérées, une deuxième étude identique est prévue afin d'évaluer le potentiel de la plateforme TZD modifiée au deutérium avec PXL065 dans l'ALD.
Début 2022, la FDA (Food and Drug Administration) des États-Unis a accordé le statut « Fast Track » (« Fast Track Designation ») et la désignation de médicament orphelin (ODD) au PXL065 et au PXL770, pour le traitement des patients atteints d'adrénomyéloneuropathie (AMN), la forme la plus courante d'adrénoleucodystrophie liée au chromosome X (ALD). Le statut « Fast Track » est accordé par la FDA aux médicaments en développement qui visent à traiter des pathologies graves ou mortelles, et répondent à un besoin médical non satisfait. L’ODD est accordé par la FDA à de nouveaux traitements de maladies ou d’affections qui touchent moins de 200 000 personnes aux États-Unis. Le statut de médicament orphelin peut faire bénéficier une société d'une exclusivité commerciale potentielle de sept ans après l'approbation de la FDA, ainsi que de réductions sur certaines redevances relatives à la soumission de dossier, et de crédits d'impôt pour les dépenses liées aux essais cliniques qualifiés menés après l'obtention de la désignation orpheline.
Le PXL770 pour le traitement de la polykystose rénale autosomique dominante (ADPKD)
La physiopathologie de l’ADPKD implique une altération du métabolisme rénal et l'activation de l'AMPK en tant qu'approche thérapeutique présente un fort intérêt. Des études précliniques ont été réalisées et ont démontré l'efficacité du PXL770 dans des tests in vitro et in vivo réalisés sur des cellules de kystes de patients atteints d’ADPKD. Au deuxième semestre 2022, la Food and Drug Administration (FDA) des États-Unis a accordé la désignation de médicament orphelin au PXL770 pour le traitement des patients atteints d’ADPKD.
Maladies rares - ALD
Diabète
TWYMEEG (Imeglimine), produit phare de Poxel et premier d’une nouvelle classe de médicaments, a été approuvé et est désormais commercialisé au Japon pour le traitement du diabète de type 2. L’Imeglimine possède un double mécanisme d’action unique qui permet de réduire la glycémie sanguine par son action pancréatique qui favorise la sécrétion d'insuline en réponse au glucose et une action extra-pancréatique qui améliore le métabolisme du glucose dans le foie et le muscle squelettique (suppression de la néoglucogenèse et amélioration de l'absorption du glucose) par une action sur les mitochondries. Ce mode d'action a le potentiel de prévenir les dysfonctionnements endothéliaux et diastoliques, ce qui peut avoir des effets protecteurs sur les défauts micro et macro vasculaires induits par le diabète. Il a également le potentiel d'avoir un effet protecteur sur la survie et la fonction des cellules bêta. Ce mécanisme d’action unique fait de l’Imeglimine un candidat de choix pour le traitement du diabète de type 2 à tous les stades de la maladie, en monothérapie ou en complément d’autres traitements antidiabétiques.
Japon & Asie
Sumitomo Pharma est notre partenaire stratégique pour l’Imeglimine au Japon, en Chine, Taiwan et la Corée du Sud et dans 9 autres pays d’Asie du Sud Est. La demande d’enregistrement de TWYMEEG (Dénomination Commune Internationale (DCI) : chlorhydrate d'Imeglimine) sous la forme de comprimés de 500 mg, a été approuvée au Japon en juin 2021 pour le traitement du diabète de type 2. Le Japon est le premier pays au monde à approuver l’Imeglimine. TWYMEEG est commercialisé depuis septembre 2021 par Sumitomo Pharma, leader du marché du diabète au Japon.
L'approbation de TWYMEEG repose sur de nombreuses études précliniques et cliniques, dont le programme TIMES de Phase III (Trials of IMeglimin for Efficacy and Safety) conduit conjointement par Poxel et Sumitomo Pharma. Ce programme comprenait trois études pivots pour évaluer l'efficacité et la sécurité de TWYMEEG chez plus de 1 100 patients. Dans le cadre de ces trois études, TWYMEEG a atteint les critères principaux d'évaluation, et a présenté un profil d'innocuité et de tolérance favorable, lorsqu'il est utilisé seul ou en association avec d’autres médicaments.
Sumitomo Pharma sera l’unique responsable du développement et de la commercialisation de l’Imeglimine en Chine, en Corée du Sud, à Taiwan et dans neuf autres pays d’Asie du Sud-Est (l’Indonésie, le Vietnam, la Thaïlande, la Malaisie, les Philippines, Singapour, le Myanmar et le Laos).
États-Unis et Europe
Dans les pays non couverts par notre partenariat avec Sumitomo Pharma, notamment les États-Unis et l’Europe, Poxel détient l’ensemble des droits de l’Imeglimine et évalue désormais les possibilités d’exploiter les données cliniques de l’Imeglimine dans des territoires spécifiques, y compris celles résultant de sollicitations directes.
Diabète
Autres opportunités dans le portefeuille
Des études précliniques évaluent actuellement l’activation directe de la protéine kinase activée par l’adénosine monophosphate (AMPK) ainsi que notre plateforme de molécules de thiazolidinediones deutérées (TZD) dans d’autres maladies chroniques et rares et orphelines.